Как мы знаем, различные производители используют для производства дентальных имплантатов и ортопедических компонентов к ним различные титановые сплавы, которые считаются производителем наиболее оптимальными в каждом случае. Так, например, титановый сплав Ti 6AL-4V ELI относящийся к категории медицинских титановых сплавов, является одним из самых используемых сплавов во всех направлениях медицины. Многие производители имплантационных систем используют именно его в т.ч. и для производства имплантатов. Например, такие как лидеры по продажам дентальных имплантатов на рынке США – американские компании 3i и Zimmer, объединившиеся недавно в одну корпорацию Zimmer Biomet. Или старейший французский стоматологический производитель Anthogyr, сегодня входящий в состав STRAUMANN GROUP. Израильская Alpha—Bio, с 2008 года принадлежащая компании Nobel Biocare (подразделение крупнейшей в мире американской медицинской корпорации Danaher Corporation). Эти и многие другие компании используют в своем производстве титановый сплав Ti 6AL-4V ELI из-за оптимального соотношения биосовместимости, устойчивости к коррозии и прочности. По этим же причинам данный сплав используют для производства эндоканальных стоматологических штифтов такие крупнейшие производители эндодонтической продукции, как швейцарская компания Maillefer входящая в состав Dentsply—Sirona и Anthogyr. Компании, использующие для производства дентальных имплантатов сплавы других категорий (например Grade 4 или Roxolid® разработанный и применяемый компанией Straumann) успешно производят из сплава Ti 6AL-4V ортопедические компоненты для постоянных и временных протезов.
Компании, использующие для производства дентальных имплантатов сплавы других категорий (например Grade 4 или Roxolid® разработанный и применяемый компанией Straumann) успешно производят из сплава Ti 6AL-4V ортопедические компоненты для постоянных и временных протезов.
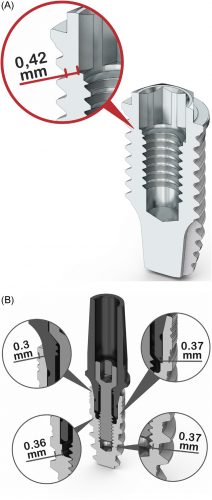
Сплав Ti 6AL-4VELI (Extra Low Interstitial — супер чистый) отличается от сплавов коммерческого чистого титана CP-Ti (Grade 1-4) наличием легирующих добавок в своем составе. Легирующие добавки обеспечивают значительное увеличение прочностных характеристик сплава, что имеет важное значение при производстве имплантируемых изделий эксплуатируемых под нагрузкой. Поэтому сплав Ti 6AL-4VELI используется при изготовлении протезов для полной замены тазобедренного и коленного сустава.

Также сплав Ti 6AL-4VELI имеет более высокий порог прочности на разрыв относительно сплава коммерчески чистого титана CP-Ti (Grade 1-4). 895 МПа к 550 МПа соответственно, что выше более чем в 1,6 раза (1).
Существуют различные точки зрения на выбор того или иного титанового сплава для производства медицинских изделий, в частности дентальных имплантатов. Однако, до сегодняшнего дня определенной единой позиции научного и медицинского сообщества по данному вопросу нет. Нет и какого-то массива исследований, позволяющих однозначно определить окончательный ответ. Исследование «Промышленный чистый титан (cp-Ti) versus титановый сплав (Ti6Al4V) как материалы для имплантатов, фиксированных в кости — или один действительно лучше, чем другой?», вышедшее недавно в научном журнале Materials Scienceand Engineering C Volume 62, 1 May 2016, Pages 960-966, проведенное Фуркан А. Шах, Маргарита Тробос, Питер Томсен, Андерс Палмквист, Кафедрой биоматериалов, Институтом клинических наук, Sahlgrenska Academy в Гетеборгском университете, Гетеборг, Швеция и BIOMATCELL VINN Центром совершенствования биоматериалов и клеточной терапии, Гетеборг, Швеция (5), систематизирует отсутствие фактов превосходства одного материала над другим.
Для анализа ситуации исследование поставило три вопроса:
- Насколько отличаются свойства поверхностей при одинаковом процессе обработки промышленного чистого титана (cp-Ti) и титанового сплава (Ti6Al4V)?
- Реагирует ли костная ткань по-разному на два материала?
- Реагируют ли бактерии, вызывающие биоматериал-ассоциированные инфекции, по-разному на два материала?
Для поиска ответа на первый вопрос был использованы данные полученные методом (XPS)– (РФЭС). Рентгеновская фотоэлектронная спектроскопия— полу количественный спектроскопический метод исследования элементного состава, химического и электронного состояния атомов, на поверхности изучаемого материала. Данный метод исследования может использоваться в том числе для анализа разницы состояния вещества, как в спокойном состоянии, так и после его обработки.
В нашем случае рентгеновская фотоэлектронная спектроскопия (XPS) показала, что поверхность Ti6Al4V в основном состоит из TiO 2 с небольшим количеством Аl в трехвалентной катионной конфигурации (Аl3 +), при этом не был обнаружен ванадий в спонтанно образовавшейся оксидной пленке [2].
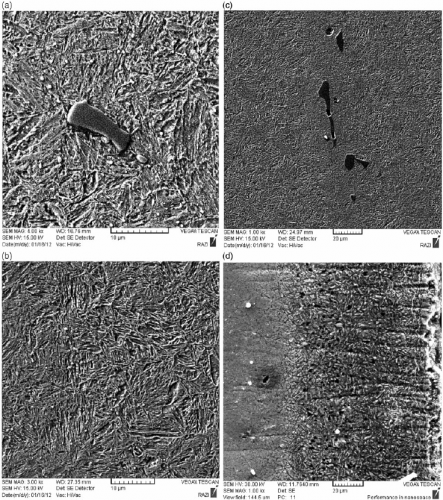
Поверхности ср-Тi и Ti6Al4V имеют умеренную смачиваемость и гидрофильность со сходными свойствами водопоглощения [3]. Микроструктура поверхности, образуемая вследствие воздушно-абразивной обработки, протравливания кислотой, или анодизации уменьшает смачиваемостьи ср-Тi, и Ti6Al4V [4].
Второй вопрос, касающийся костной реакции на оба сплава, был проработан с помощью глубоко анализа литературы по результатам экспериментальных исследований, который был направлен на выявление неоспоримых преимуществ одного материала (ср-Ті, или Ti6Al4V) по сравнению с другим для подтверждения этой гипотезы. Принимались во внимание только сравнительные исследования invivo, в которых оценивали титановый сплав (Ti6Al4V) Grade-5 класса и ср-Ті (как контрольный материал). Известны лишь несколько сравнительных исследований тканевых реакции на чистый титан, или титановые сплавы. В большинстве исследований использовали другие материалы или поверхности в тех же публикациях, или не было точной статистической оценки, или анализ не выявил статистического различия (5).
Большинство имеющихся исследований проводили на кролях, бабуинах и крысах. Оценивали период заживления продолжительностью от 3 дней до 12 месяцев с такими конечными анализами: (I) контакт имлантат-кость (BIC) (II) участок кости между витками резьбы (ВА) 4 (III) толщина кости (IV) крутящий момент удаления (RTQ) (V) предел прочности; (VI) резонансно-частотный анализ (RFA) и (VІІ) ультраструктурный анализ поверхности. Из анализированных публикаций, в одной не указаны существенные различия в ВА, или BIC между ср-Тi и Ti6Al4V [6]. В трех публикациях указаны более высокие значения RTQ для ср-Тi [9, 7, 8], в двух из которых также указывается соответственно более высокие значения предела прочности [9, 7] — гибридный параметр основывается на значениях RTQ и ВІС, тогда как в третьей публикации этот параметр не учтен [8]. Напротив, в нескольких исследованиях указаны более высокие значения RTQ для Ti6Al4V имплантатов, но без статистического анализа [8, 10]. Более того, трудно сравнивать фактические значения, полученные в разных исследованиях, поскольку измерения не проводили сравнительным, или стандартизированным способом.
С точки зрения гистологической оценки по данным большинства публикаций, не обнаружено никаких гистологических доказательств различий между ср-Тi и Ti6Al4V относительно костного ответа в контрольных периодах (5).

Вопрос бактериального взаимодействия. На сегодняшний день проведено недостаточно сравнительных исследований инфекций invivo между материалами ср-Тi и Ti6Al4V. Физические, химические и топографические свойства биоматериала, как и виды бактерий и вирулентных свойств культур, могут влиять на бактериальное прикрепление и образование биопленки в биоматериал-ассоциированных инфекциях (5).
Прикрепление нескольких грамположительных (S. epidermidis и Streptococcus Sanguinis) и грамотрицательных (Serratiaspecies и Escherichiacoli) бактерий сравнимо как на ср-Тi, так и на Ti6Al4V [11]. Подобные наблюдения проведены в исследовании адгезии S. еpidermidis к Ti6Al4V сплаву и отдельно к поверхности чистого титана, алюминия и ванадия, где сходное количество бактериальных клеток прикреплялась к чистому титану и Ti6Al4V [57]. Дополнительно исследования invitro прикрепления S. еpidermidis подтвердили сходство результатов в случае ср-Тi и Ti6Al4V [12, 13].
ВЫВОД:
Рассмотрев выше указанные вопросы, коллектив авторов (Фуркан А. Шах, Маргарита Тробос, Питер Томсен и Андерс Палмквист) пришел к следующим выводам (5):
- Обработанные поверхности ср-Тi и Ti6Al4V имеют сходную морфологию, топографию, фазовый и химический состав.
- Бактериальная адгезия к поверхностям является мультифакторной и зависит от вида и штамма бактерий. Что важно, опыты invitro не смогли выявить различия между ср-Тi и Ti6Al4V в качестве субстрата для роста S. еpidermidis (распространенный патоген при хирургических вмешательствах). Другие исследования invitro демонстрируют противоречивые результаты, предпочитая один материал другому, в зависимости от изучаемого вида бактерий и методологического подхода.
- Экспериментальные исследования костного ответа на обработанные материалы ср-Тi и Ti6Al4V обнаружили похожую остеоинтеграцию. Хотя в некоторых публикациях (все из одной группы) была указана более высокая биомеханическая способность ср-Тi, результаты других исследовательских групп не смогли представить убедительные доказательства качественных и количественных различий между ср-Тi и Ti6Al4V в процессе заживления кости и адаптации.
- Очевидно, что лишь несколько клинических сравнительных исследований было выполнено для определения долгосрочных клинических различий между ср-Тi и Ti6Al4V. Основываясь на данных доступной современной литературы, можно резюмировать, что в условиях эксперимента материалы ср-Тi и Ti6Al4V демонстрируют сходную остеоинтеграцию и биомеханическое сцепление.
Список использованной литературы
- ASTM Standard B265 — 13ae1, Standard Specification for Titanium and Titanium Alloy Strip, Sheet, and Plate, ASTM International, West Conshohocken, PA, 2013
- Ask, U. Rolander, J. Lausmaa, B. Kasemo, J. Mater. Res. 5 (1990) 1662–1667.
- Ponsonnet, K. Reybier, N. Jaffrezic, V. Comte, C. Lagneau, M. Lissac, C. Martelet, Mater. Sci. Eng. C 23 (2003) 551–560.
- N. Sela, L. Badihi, G. Rosen, D. Steinberg, D. Kohavi, Clin. Oral Implants Res. 18(2007) 630–638.
- Furqan A. Shah, Margarita Trobos, Peter Thomsen, Anders PalmquistMaterials Science and Engineering CVolume 62, 1 May 2016, Pages 960-966
- Saulacic, D.D. Bosshardt, M.M. Bornstein, S. Berner, D. Buser, Eur. Cell. Mater. 23(2012) 273–286 (discussion 286-278)
- H. Han, C.B. Johansson, A. Wennerberg, T. Albrektsson, Clin. Oral Implants Res. 9(1998) 1–10.
- B. Johansson, C.H. Han, A. Wennerberg, T. Albrektsson, Int. J. Oral Maxillofac.Implants 13 (1998) 315–321.
- F. Stenport, C.B. Johansson, Clin. Implant. Dent. Relat. Res. 10 (2008) 191–199.
- C. Mendes, R. Moineddin, J.E. Davies, Biomaterials 28 (2007) 4748–4755
- Wang, University of Birmingham, Birmingham (2011).
- Shida, H. Koseki, I. Yoda, H. Horiuchi, H. Sakoda, M. Osaki, Int. J. Nanomedicine 8 (2013) 3955–3961.
- A. Schildhauer, B. Robie, G. Muhr, M. Koller, J. Orthop. Trauma 20 (2006) 476–484.

